连线杂志的Maggie Chen报道了一些针对冠状病毒疫苗的最新进展。几组科学家已经开始研究一种根据纳米颗粒而开发的疫苗,他们通过找到冠状病毒家族中共享的受体结合域,来开发一种针对大多数冠状病毒的疫苗,其中包括非典和新冠的大多变种。还有一种叫做纳米陷阱的技术也正在开发中。
在疫情的早期,接种疫苗或或与新冠斗阵一番,似乎可以抵御再次感染的风险。但是现在,新的病毒变体越来越能够躲避这种来之不易的保护。追踪这些变体以及它们如何逃避免疫保护是令人疲惫的,科学家们希望用一种新型疫苗来压制还没有成功进化的病毒。
科学家们已经尝试了几种途径来解决这个问题。最狭隘的路线是从现有的mRNA新冠疫苗开始,并试图创造出针对病毒最新变体的最新加强针,制药商莫德纳和辉瑞公司正在尝试用奥密克戎的后代进行这一努力。
最大规模、最雄心勃勃的路线是发明一种针对整个冠状病毒家族的疫苗,包括导致MERS的梅克韦尔病毒、导致普通感冒的栓塞病毒,以及引起新冠和2002年爆发的最初非典病毒的乙型冠状病毒亚属。
但还有一条中间道路:一种只攻击乙型冠状病毒的疫苗,即新冠病毒及其所有未来的后代,以及未来可能出现的任何新SARS-CoV的兄弟姐妹。这个管道已经有几个候选药物;一些已经在灵长类动物或小鼠身上进行了测试,一个正在进行针对人的小型临床试验。所有这些都利用了碳纤维病毒所共有的共性,可以用来打击它们的整个血统。
正在开发这种疫苗的加州理工学院博士后研究员亚历克斯·科恩说:“如果你有办法针对这些非常受保护的部分,就可能有办法针对所有这些乙型冠状病毒。”他补充说,理想情况下,这种全面的保护可以通过“一种类型的疫苗接种,或一种类型的免疫接种”来实现。
下面我们来看看正在开发的一些候选产品。
马赛克纳米颗粒(Mosaic Nanoparticle)疫苗
科恩在加州理工学院生物和生物工程系的帕梅拉·比约克曼实验室工作,实验室最近在《科学》杂志上发表了一篇关于他们的候选疫苗的论文,显示其在猴子和小鼠身上表现出对多种乙型冠状病毒株的保护。他们的疫苗是一种基于嵌合纳米颗粒的疫苗,这意味着它是建立在一个微小的、类似笼子的蛋白质球上。
他们的想法是训练免疫系统来攻击许多乙型冠状病毒共同的目标。加州理工学院的实验室选择了新冠著名的穗状蛋白的一部分,称为受体结合域(receptor binding domain,RBD),它帮助病毒进入并感染宿主细胞。
RBD在不同的猿猴病毒中通常是在进化中被保存下来的,这意味着尽管结合部位的一些区域可能随着新变体的出现而发生突变,但其他区域保持不变。(作为一个假设的例子,德尔塔和奥密克戎变体将有类似的RBD,但也有一些差异)。这种相似性创造了一个机会。如果你能鼓励身体产生针对这些共享区域的抗体,它们就能针对许多不同的变体提供保护,而不仅仅是一个。
比约克曼的团队通过研究以前感染过新冠的病人的抗体,并分析这些抗体将在尖峰蛋白的RBD上结合的位置,提出了这个计划。比约克曼拿出了一个与她的头差不多大小的刺突蛋白模型(换句话说:非常不符合比例)。她指着RBD顶端的一个区域说:“在早期,人们从受感染的人身上分离出这么多有效的中和抗体,它们阻止了受体的结合。但是随着变种的出现,它们不再起作用了”。
她的团队意识到,那些曾经看起来如此强大的早期抗体会与RBD的最外层区域结合。这些部位是攻击病毒最早版本的有效目标。但是这些区域随着时间的推移发生了变异。一旦发生变异,抗体就很难抓住它们并中和病毒。
然而,其他更罕见的抗体可以与一个更难达到的区域结合,这个区域不那么容易变异。比约克曼指着RBD的一个部分,这个部分比尖端更接近刺突蛋白的中部,表明了那些特殊抗体结合的地方。她说:“这些是我们真正想要的抗体,因为RBDs应该在乙型冠状病毒之间,以及在SARS-CoV-2可能出现的任何变体之间保持”。
他们的疫苗的任务,是促使免疫系统产生能够抓住这些共享点的抗体。
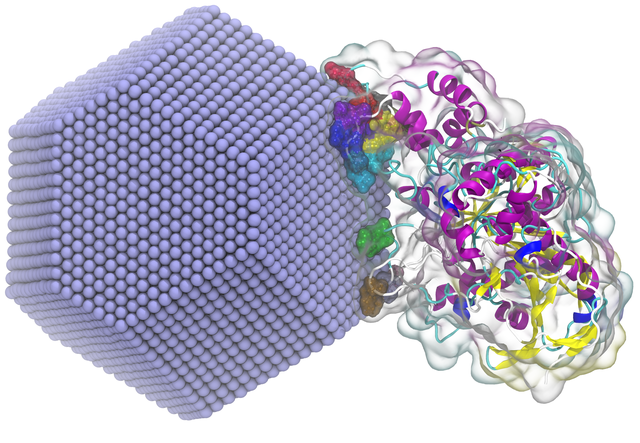
团队的第一步是将他们的纳米颗粒变成一种模板,以训练免疫系统制造这些抗体。他们将蛋白质纳米颗粒外壳浸入八种不同的RBD混合物中,这些RBD粘附在表面,有点像用一颗粘稠的苹果糖去沾不同的坚果。比约克曼说,因为“它们没有理由去任何特定的地方”,最终产品是一种表面有不同RBD随机组合的纳米颗粒。(“马赛克纳米颗粒”中的“马赛克”就是由此而来。)
当注射到动物体内时,动物免疫系统中负责产生保护性抗体的B细胞,将开始制造攻击这些结合点的抗体。如果动物以后遇到实际版本的病毒,它的抗体就会知道该粘附在这些部位,阻止病毒进入细胞。
你可能会认为这种八种RBD方法会产生只针对八种不同结合位点的抗体。但是研究人员利用了抗体形状上的一个怪癖。它们是双臂型的,形状像字母Y。它们可以被设计成用双臂与两个相邻部位的保存区域结合,而不是用一个臂与一个RBD类型的特定区域结合。这意味着,理论上它们可以附着在具有这些保存区域的任何区域上,而不是只粘住八个特定的乙型冠状病毒RBD。
首先,科学家们在小鼠身上测试了他们的疫苗,这些小鼠被分成六组。其中两组用马赛克纳米颗粒进行免疫,然后每组接触新冠的贝塔变体或SARS-CoV-1,即2002年的第一个SARS病毒。所有12只接种疫苗的小鼠都活了下来。相比之下,大多数未接种疫苗的小鼠接触到这两种病毒后,体重减轻并死亡。
接下来,研究小组对猕猴进行了类似的实验,猕猴被分成四组。其中两组通过注射三次马赛克纳米颗粒进行免疫。然后,在第三次注射后约一个月,这些动物被暴露在新冠的德尔塔变体或原始非典病毒中。没有一只接种疫苗的猴子感染了这两种类型的乙型冠状病毒,尽管德尔塔对照组的四只猴子中有三只出现了感染,而非典对照组的所有猴子都出现了感染。
重要的是,在猴子的实验中,原始的非典和德尔塔 RBD都没有包含在马赛克的纳米颗粒上。对研究小组来说,这表明接种后产生的抗体针对的是疫苗没有明确提供免疫的病毒版本,而且它对一系列的乙型冠状病毒是有用的。
科恩说:“动物引起了相当一致的反应,它们的抗体对我们测试的每种冠状病毒都有相当大的交叉反应,包括那些不存在于颗粒上的病毒。”
其他纳米颗粒类的竞争者
这些发现将马赛克纳米颗粒添加到一个不断变长的RBD,或者更宽泛地说,基于刺突蛋白的疫苗名单中,这些疫苗已经由世界各地的不同学术团体创建。华盛顿大学的科学家们正在开发的一种候选疫苗已经在小鼠身上进行了测试,另一种目前正在沃尔特·里德陆军研究所进行第一阶段的临床试验。另一种准备进入人体临床试验的疫苗由生物学家凯文·桑德斯和杜克大学人类疫苗研究所的同事开发,他们于2021年6月在自然杂志上发表了一篇描述工作进展的论文,并在2022年1月分发了另一篇预印本。
与比约克曼的研究小组一样,桑德斯的研究小组也注意到,对多株乙型冠状病毒有保护作用的抗体是针对RBD的最内端,而且这些抗体以及其他抗体可以通过纳米颗粒提供的免疫力产生。
但与加州理工学院团队的八种RBD镶嵌式纳米颗粒不同,这个版本只依赖原始新冠病毒的一种RBD类型。纳米颗粒也是不同的;它是基于从幽门螺旋杆菌中提取的铁蛋白(ferritin,一种储存铁的蛋白质)外壳。(桑德斯指出,铁蛋白纳米颗粒已经被用于流感疫苗,使其成为“具有一定临床经验的纳米颗粒平台”)。
在他们2021年的论文中,他们还对猴子进行了测试。他们发现,在猕猴身上,他们的疫苗产生的抗体可以抵御原始新冠病毒。然后在2022年的预印本中,科学家们用贝塔和德尔塔的新冠变体挑战了更多的免疫猕猴,这篇预印本尚未发表或接受同行评审。
他们把猴子分成几个小组,每组5只。一个免疫组和一个未接种疫苗的对照组接触贝塔变体,而另一个免疫组和对照组则接触德尔塔变体。免疫组的猴子几乎没有显示出可检测到的病毒水平,表明疫苗保护它们免受感染,而大多数对照组的猴子则显示出病毒水平。
尽管研究人员只使用了一个版本的新冠RBD,但他们的疫苗产生了强大的多克隆(polyclonal)反应,这意味着它产生了多种抗体类型,而不是只有一种。对桑德斯来说,这是这种方法的魅力之一。
他说,创造多种抗体类型是有益的,因为对某一变种极为有效的抗体,可能对另一变种不那么有效。反之亦然:一个过去弱的抗体可以更好地中和一个较新的变体。他说:“其中一些抗体将对奥密克戎有很好的反应,一些将对阿尔法有很好的反应,一些将对德尔塔有很好的反应。理想情况下,有些抗体将对还不存在的变体有很好的反应。
启动疫苗
北卡罗来纳大学教堂山分校的博士后学者大卫·马丁内斯。是几篇RBD纳米颗粒论文的共同作者,他研究了这些类型的疫苗是否可以通过佐剂(adjuvant)来促进:一种可以“启动”免疫系统的物质,与疫苗一起被输送。他说:“如果你在床上睡觉,闹钟响了,你没有起床,然后有人向你泼了一桶冰水,这就是佐剂对免疫系统的作用。”
佐剂可以由脂类、盐类或其他种类的油制成。有一种甚至含有鲨鱼的油。它们经常被用于疫苗;例如,第一个mRNA对新冠疫苗使用脂质纳米颗粒作为佐剂。
在1月份与桑德斯实验室的预印本中,团队用三种不同的佐剂测试了他们的RBD纳米颗粒疫苗。他们发现,与独立的疫苗相比,那些带有三种佐剂中任何一种的疫苗产生的抗体浓度都更高。
一种特殊的佐剂,称为3M-052-AF,产生了最高数量的抗体,可交叉中和不同的乙型冠状病毒株。虽然它的具体配方是专有的,但这种佐剂含有一种叫做TLR7/8激动剂(agonist)的东西:刺激免疫细胞以激活免疫反应的小分子。马丁内斯说,这些类型的分子“基本上可以与免疫系统对话,并使免疫系统过度活跃,以对抗它所看到的任何外部侵略”。
捕获冠状病毒
科学家们还在探索其他基于纳米的防变异疫苗接种方法。其中一种被称为“纳米陷阱”,最初于2021年6月在物质杂志上被描述为,对那些已经被感染的人的一种治疗,而不是作为一种疫苗。
纳米陷阱是一种通过吞噬作用摆脱新冠病毒的机制,也就是说,巨噬细胞或其他免疫细胞将其吃掉。纳米陷阱的工作方式有点像诱饵,它们基本上是诱使身体吞噬入侵的病毒。
这个想法可以适用于各种病毒,但芝加哥大学的生物工程师黄俊(音)和他的团队创造了一种专门针对乙型冠状病毒的纳米陷阱,因为它有一个聚合物的纳米颗粒外壳,上面镶有ACE2受体,这是新冠病毒所结合的人类细胞上的受体。由于纳米陷阱表面有高密度的ACE2受体,新冠病毒被吸引到它身上并被粘住。但这就是陷阱的作用。
撒在ACE2受体中的是配体(ligands),这些小分子可以与细胞受体结合,在这种情况下,诱导吞噬作用。人体的巨噬细胞识别配体,并吃掉其余的含有病毒斑点的纳米陷阱,从而摆脱了病毒。黄说:“我们首先抓住病毒,然后清除病毒。”
现在,黄对如何利用这些纳米陷阱作为疫苗候选物感到好奇。当巨噬细胞扑过来时,它们不仅能吃掉病毒,还能刺激免疫系统的其他部分开始产生针对病毒的抗体。创造一个带有ACE2受体的纳米陷阱,将启动免疫系统,使其产生对抗冠状类病毒的抗体。黄说:“然后我们基本上可以解决所有的变种,如果病毒失去了与ACE2结合的能力,那么它就不能感染细胞。”
接下来的步骤
黄的纳米陷阱是所有疫苗候选者中测试最少的,他已经申请了专利,并证明在从捐赠器官中提取的人类肺部组织中成功清除了感染,但尚未在感染新冠的动物中进行测试。
其他候选者已经在新冠的动物模型中证明了疗效,但进入人体临床试验可能还需要一两年的时间。桑德斯及他的同事开发的疫苗预计将在2023年进入人体临床试验;华盛顿大学的疫苗也是如此。比约克曼的小组估计,临床试验将在2024年开始。(她说:“我希望它能更早,但我们必须要通过监管步骤”。)
沃尔特·里德公司的一位代表说,他们不能提供关于他们的第一阶段临床试验的信息,要等待研究报告的发布。
同时,研究人员已经在考虑下一次大流行病的问题,以及如何将这些候选药物扩大到针对更多的冠状病毒类型。桑德斯说:“我们一直在努力真正扩大我们的疫苗效用,使其对MERS冠状病毒也有效,”他指出,MERS的死亡率约为30%,“对于呼吸道病毒来说,死亡率很高”。

但考虑到进行人体测试所需的时间,它们未来的效用可能来自于对抗我们甚至还没有想象过的乙型冠状病毒。科恩乐观地认为,从这些实验中获得的经验可以帮助处理未来的人畜共患传染病,即从其他动物交叉感染到人类的传染病,就像新冠病毒从蝙蝠身上溢出一样。
他说:“认为未来会有更多的动物溢出,这其实并不牵强。因此,拥有针对这整个类别的病毒的东西,可能对预防,或至少是减轻任何未来的暴发是有用的。”


