据彭博社作者Max Nisen6月7日的报道,美国食品药品监督管理局(FDA)在证据不足的情况下批准了百健公司(Biogen Inc.)一款有争议的药物,该行为被认为有可能损害机构的声誉、美国的健康预算和药物研究的质量。
疫情期间,“遵循科学”是一个一以贯之的原则,也通常是FDA评估药物的准则。但是当涉及到该机构最重要的决定之一,在周一批准百健公司争议极大的阿尔茨海默症新药物Aducanumab时,科学就退居其次了。
阿尔茨海默氏症是一种毁灭性的疾病,除了缓解症状外没有任何治疗方法。百健公司的药物是第一个据说可以减缓衰退的药物。如果有很好的证据表明能做到这一点,这将会是一个突破,但问题是在数据上还并不能确定。虽然FDA在患者没有选择的情况下,是应该要更灵活的做出决断,但这个决定不仅仅是弹性对待标准。
事实上,FDA打破了标准。
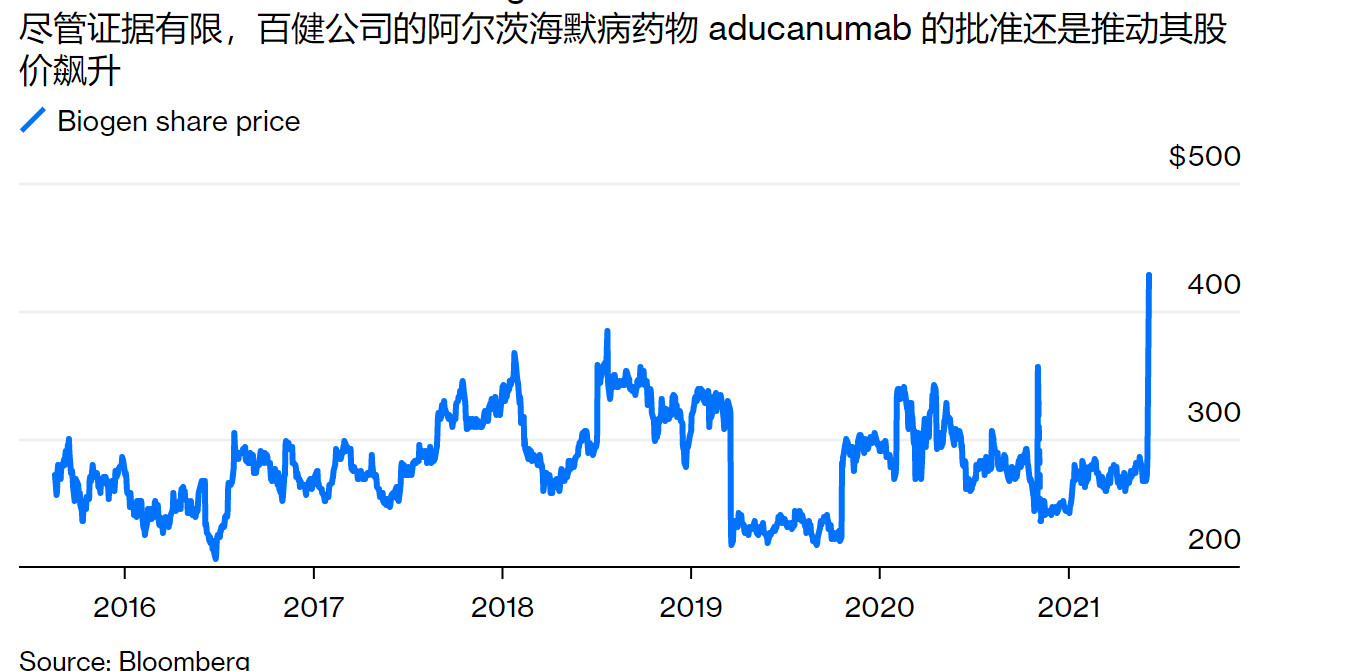
对于百健公司的投资者来说,批准是巨大的胜利,为一个可能创造数十亿美元销售额的轰动性药物奠定了基础,并增加了这个公司的市场价值;在最初的停牌之后,周一的新闻让公司的股票飙升了50%。
对其他人来说,批准是一个错误;FDA的许可有可能损害这个权威机构的声誉、美国的健康预算和药物研究的质量,也包括对阿尔茨海默氏症的研究。
问题是这样的。
百健公司在2015年开始了两项相同的研究,以测试该药物是否能减缓早期阿尔茨海默病。然而,在早期分析表明成功率较低后,公司于2019年3月停止了这两项研究。本来这个药物结局已经定了,直到几个月后,百健公司突然宣布,增加了新的数据之后,这两项试验中的一项被证实有效,同时百健计划提交药物销售申请。
早期的叫停是有问题的。百健公司只收集了它想要的一小部分病人数据,导致了统计学的不确定性。但最大的问题是,第二项研究失败了,而且离证明有效还差得很远。FDA对批准阿尔茨海默氏症的理想标准,是来自两项成功的研究证据。
人们有充分的理由,希望有一个高标准和可重复的实验数据,毕竟客观地衡量精神衰退比衡量肿瘤的大小要难得多,因此获取明确的临床实验数据尤为关键。
FDA回避了这一标准,给予这个药物所谓的加速批准,使用了一种特别的监管途径,其让FDA在病人缺乏选择的领域,接受不同类型的证据。
这并没有使他们的决定更有说服力。
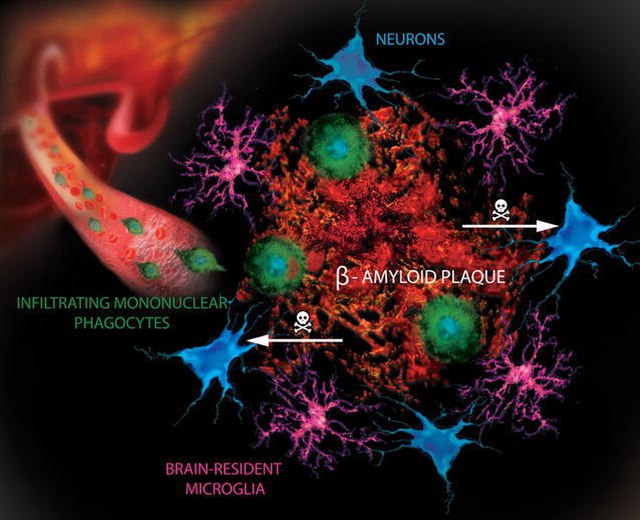
在这种情况下,批准的重点是Aducanumab去除淀粉样蛋白斑块( amyloid brain plaques)的能力,据信这在阿尔茨海默病中起着作用。百健公司的药物价格不菲,每年约5.6万美元,是可以减少斑块,但即使在积极的试验中,对病人所产生的好处也很有限,可能并不显著。
许多其他药物都针对淀粉样蛋白。不幸的是,所有的药物都未能帮助患者,导致科学家们质疑去除斑块是否有任何作用。
百健公司的相反结果,只是增加了淀粉样蛋白作用的不确定性,并不足以使其可以接受,虽然可能会产生数十亿美元的市场价值。可以肯定的是,去除斑块有时会导致严重的副作用,包括脑肿。
百健公司对试验失败的解释,是剂量不足和少量迅速衰退的病人。但是,不幸的是,这就是所谓的事后分析,或者直白地说是以偏概全,而且从根本上说,有着不可改变的偏见。优秀的科学家可以使用这样的方法来为未来的测试产生想法,而不是作为一代重要药物审批的试金石。
人们本来会期望FDA进行反击。但是,在这种情况下,监管机构的一部分人不仅改变了其标准,而且通过审批程序与百健公司合作、在这个过程中,监管机构与百健公司的关系如此亲密,以至于消费者权益组织“公共公民 ”(Public Citizen)已要求政府调查。更进一步的是,在11月,由FDA召集的评估该药物的独立专家小组,也普遍建议不批准该药物。
此外,监管机构自己的统计专家,对作为11月审查的一部分提交的简报包中的证据提出了严厉批判。6月2日,美国老年医学会,一个致力于老年人的健康专家团体,直接写信给FDA的临时专员,建议反对批准。
FDA似乎已经屈服于压力,不顾后果地给病人以希望,即使可能是假的,而且有很多后果。
如果该机构批准了证据不充分的药物,这就是FDA将得到的结果:医药公司们将更有可能根据不完善的临床结果寻求批准或推进项目,浪费时间和研究经费,以及不顾参加临床试验的病人的健康。
至于阿尔茨海默病,未来的药物可能会被严重拖延。有了获批的治疗方法,招募人们参加临床试验可能会变得更加困难。而且,现在FDA已经验证了淀粉样蛋白是一个目标,医药公司可能会因为过分专注于此,而牺牲其他可能更有成效的途径。
新药物的高昂价格只是患者经济损失的开始。获得这种药物需要医生的详细问询和检查,以确定资格和监测副作用,为医疗保险、病人和他们的护理人员创造大量的额外费用。哪怕只将这些费用乘以数百万美国阿尔茨海默氏症患者的一小部分,都会出现预算危机。
美国食品和药物管理局将让百健公司进行另一项试验,以确认或者确定该药物的益处。但这只是昂贵的踢皮球行为。因为新药将同时在市场上销售,而公司经常在确认性试验上拖后腿,如果试验失败,可能会使盈利的药物下架。
在这种情况下,进行这样的试验将是非常困难的,因为很少有人会自愿服用安慰剂。如果FDA要求在2019年进行另一项试验,我们可能很快就会知道这种药物是否有效。如果不是如此,那就算我们能得到答案,也是多年以后的事了,而美国将在可能是有副作用的安慰剂上花费大量资金。
这个世界确实迫切需要一种治疗老年痴呆症的药物,但是让一种昂贵的药物,基于很少的数据进入市场,并不是解决问题的办法。


